荧光显微镜
MicroTime 200 STED
超分辨时间分辨共聚焦荧光显微系统
- 基于倒置显微镜的完整共聚焦STED系统
- 光学分辨率低于50nm
- 640nm激发,595nm和660nm附加可选
- 支持门控STED(gSTED)和gSTED-FCS
- 压电平移台,用于2D,3D寿命成像和精确定位
- 匹配有高级版易用型数据采集、分析和可视化软件SPT64
- AFM/FLIM/STED联用的独特升级
- 支持MicroTime 200可用的所有其他手段,即FLIM、FCS、FCCS、FLCS、FRET等
-
FLIMbee 振镜扫描附件,具有出色的扫描速度灵活性和优秀的空间精度
- 可以通过使用FLIMbee振镜在X轴上进行线扫描来实现scanning FCS测量
近年来,超分辨率显微镜得到了越来越多的关注。现在它已经超越了研发阶段,并应用于研究以前被光的衍射极限所掩盖的生物学样品。超分辨率成像最普及的技术之一是受激发射损耗(STED)显微镜。STED通常用共焦显微镜为主体,因此非常适合添加到MicroTime 200中。将STED集成到系统中,一直朝着最高的稳定性和易用性发展。该系统能够无需冗长的准备工作就可以运行STED显微镜,同时仍然可以选择使用MicroTime 200的全部功能。

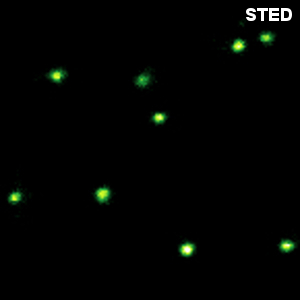
小于50nm的光学分辨率
STED显微镜利用受激发射损耗的原理。在激发激光焦点中的荧光团后,用第二个波长更长的、甜甜圈状的激光来通过主动损耗被激发的分子外围。在MicroTime 200 STED中,甜甜圈的光斑是用EASYDOnut相偏板完成的。在光路中,它将STED激光焦点改变为甜甜圈形状,而激发光不受影响。这种简单的实现方式免去了来自同一根光纤的两个激光束的对准工作,并且实现了空间分辨率小于50 nm。由于MicroTime 200 STED的时间分辨数据采集原理,还可以将时间门控应用于所有测量数据。这种门控STED(gSTED)方法可进一步提高图像分辨率,并减少FCS的观测时间。

激发波长可选
MicroTime 200 STED配有激光耦合单元,该单元将激发光与STED损耗光集成在一起。标准的激发波长是640nm,可选与595nm和660nm激光组合,用于双组分扫描成像。由于STED损耗光在765 nm处具有很高的功率,因此在操作仪器时要特别注意以确保使用者安全。MicoTime200的标准激光耦合单元也可以连接到系统上,用于非STED应用,如FLIM、FRET或FCS。
激光功率和重复频率可以通过多通道激光驱动器PDL 828“ Sepia II”进行灵活调整,该驱动器可以并行驱动多个激光器,从而实现脉冲交替激发(PIE)等高级功能。激发脉冲和STED脉冲之间的时间延迟也是可调的,以实现最高的灵活性和最佳的STED分辨率。

扫描技术
MicroTime 200平台的强大的多功能性得到了FLIMbee振镜的补充,它可以提供从非常慢到快的扫描速度,同时保持较高的精度。高灵活速度的扫描可以用于rapidFLIM技术,来实现从磷光寿命成像(PLIM)到快速荧光寿命测量的应用。此外,由于其高精度和高灵敏度,FLIMbee振镜适用于STED进行超分辨显微成像,从而使成像分辨率提升至单分子水平。
配备了FLIMbee振镜的MicroTime200是单光子检测(SMD)的理想选择,如:spFRET、PIE-FRET、(STED-)FCS、FLCS,、FLCCS、双聚焦FCS (2fFCS),甚至各向异性的测试。此外,还可以进行共聚焦和NDD检测的双光子激发(TPE)。
FLIMbee振镜的核心是由三个高精度转向镜组成,它们具有出色的线性度、重复性和低漂移。两个Y轴振镜保证激光光束固定在物镜入口。这个镜子结构最大程度减小了像场的渐晕,确保在较宽的扫描范围内保持恒定的聚焦体积。使用100x物镜时,FLIMbee振镜可提供低至10nm的最小像素尺寸。

单光子灵敏度的探测子系统
在MicroTime 200 STED中,可通过压电平台方便地进行扫描,可选高精度PiFoc压电Z轴实现3D成像。压电扫描可确保较高的重复定位精度和稳定性,这对于高质量STED图像至关重要。系统最多可配置六个并行检测通道。对于使用在765 nm损耗光的STED染料,通常使用SPAD,因为SPAD在该光谱范围内具有高达70%的高检测效率。

皮秒分辨率的门控STED
TCSPC模块采用皮秒分辨率的时间标记的时间分辨(TTTR)数据采集模式。所获取的TTTR数据不仅可以用于常规STED成像,还可以执行门控STED(gSTED)测量。TTTR数据采集模式的优势在于,它仅基于一种基本数据格式,就可以实现包含STED和其它多种功能,例如FLIM、FCS甚至符合相关(“反聚束”)等应用。 PicoQuant的所有可用TCSPC模块都支持TTTR格式。

直观的数据采集和分析
SymPhoTime 64,是MicroTime 200 STED的系统软件, 具有专用于STED数据采集和分析功能。比如,预设的时间门控已集成在测试预览功能中,并且可以在数据分析过程中,为更高STED分辨设置更加灵活的时间门控。独特的荧光“模式匹配”功能可以用于从同样STED激光波长记录的数据中分离多种物质。
FLIM、FRET、FCS等
MicroTime 200 STED不仅具有STED和STED-FCS功能,而且还支持MicroTime 200可用的所有其他测量和分析程序。这包括FLIM,FCS,FCCS,FLCS,FRET,PIE-FRET或强度时间轨迹等等。
|
光学分辨率 |
<50 nm(STED) <300 nm(共聚焦) |
|
激发系统 |
激光耦合单元,包含皮秒半导体激光器(375 nm – 900 nm),复频率高达80 MHz 支持单通道或多通道驱动 可选:支持紫外266 nm* 可选:支持外接第三方激光器(如钛蓝宝石激光器) STED激发光部分 640 nm(激发光),765 nm(STED激光) 双样品STED采用640 nm和595 nm激发光 双样品STED采用640 nm和660 nm激发光 |
|
显微镜 |
Olympus的IX 73或IX 83倒置显微镜 专为共聚焦显微镜设计的右侧端口 预留左口和后口,可做扩展应用(如TIRF) 包含透射照明部件 独特的25 mm行程的手动样品固定台 标准样品架(用于20 mm x 20 mm载玻片) 可选落射荧光照明 可选低温恒温器用于低温型实验 可选与原子力显微镜整合 |
|
物镜规格 |
标准20x和40x空气物镜 可选多种高端特殊物镜(水/油镜、红外/紫外强化、TIRF、超长工作距离型等) |
|
扫描台 |
压电平移台: 80μm x 80μm规格2D压电扫描台(1nm定位精度) PIFOC 3D立体成像(行程80 μm,定位精度1 nm) 可选样品扫描 可选厘米级大范围扫描台 FLIMbee振镜扫描头: 图像尺寸范围从10 × 10到2048 × 2048像素 最大视野:250 × 250µm(60x物镜) 高达2.6kHz的线扫描(双向扫描),5.2FPS @ 512 × 512像素 可选Z轴控制,如z-stacks (基于压电Z轴位移台,最大100μm行程) 像素停留时间0.5 µs到1 s |
|
主要光学部件 |
最多可支持4通道的共聚焦探测模块 定制高端二向色镜,增强系统稳定性 所有光学组件容易安装、调整和更换 用于光斑分析的CCD相机和光电二极管 变量分束单元和出口端口,轻松连接外部设备 |
|
探测器 |
单光子雪崩二极管(SPAD) 混合型光电倍增管(Hybrid-PMT) |
|
数据采集方式 |
基于时间相关单光子计数(TCSPC)的TTTR测量模式 多达独立6通道同步采集 |
|
分析软件 |
SymPhoTime 64 |
MicroTime 200 STED是一款具有单分子灵敏度和超分辨率成像功能的时间分辨共聚焦显微镜。 因此,该仪器可以进行多种应用,包括:
- 受激发射损耗显微镜(STED)/门控STED(gSTED)
- 单分子光谱/探测
- 时间分辨荧光
- 荧光寿命成像(FLIM)
- 磷光寿命成像(PLIM)
- 荧光相关光谱(FCS)
- 荧光寿命相关光谱(FLCS)
- 荧光共振能量转移(FRET)
- 双聚焦荧光相关光谱(2fFCS)
- 扫描FCS (sFCS)
- 脉冲交替激发(PIE)
- 荧光各向异性(偏振)
- 模式匹配分析
- 时间分辨光致发光(TRPL)
- TRPL 成像
- 反聚束效应
Add-on options选项:
与光镊结合使用
PicoQuant和Ionovation联合开发,将时间分辨显微镜和光镊结合在一个系统中。两种仪器都保留其各自的功能,而且还可以一起使用,从而使客户能够对诸如细胞等被捕获物体进行时间分辨荧光显微分析(例如荧光寿命成像)。
Ionovation的PicoTweezers系统是一款紧凑有力的光镊设备,并配备实时视频检测。与普通光镊系统相比,PicoTweezers没有空间限制,并且与所有样品载体兼容。该系统非常适用于分子相互作用研究、力学、细胞捕获、流式学和许多其他应用。

与原子力显微镜AFM结合使用
原子力显微镜和单分子灵敏度的共聚焦荧光显微镜MicroTime200相结合,使结构学、动力学和单分子研究有机的结合在一起。原子力显微镜揭示了纳米级分辨率的大分子复合物的结构,而荧光有助于组成部分的识别。此外,由于原子力显微镜针尖的纳米光子效应,如荧光猝灭或增强,可进一步增加光学分辨率,乃至超出衍射的级别。该技术的进展使得人们首次实现了对生物样品高精度物理接触作用研究,乃其参数的测量。
所述的MicroTime200目前已经兼容三种不同的原子力显微镜:
BioScope
Catalyst: Bruker
NanoWizard 4: JPK
MFP-3D-BIO: Asylum research

单分子灵敏光谱仪选项
通过增加具有单分子灵敏CCD的光谱仪(Andor公司的SR-163)为MicroTime200对单分子的研究打开了一个新的前景。光谱仪通过一根多模光纤连接到MicroTime200主光单元的一个出口上。在主光单元内部,具有一些合适的光学元件用来将一部分发射光引导到该出口。该光学元件(100%反射镜,50/50分束器,…)可以根据用户的实验要求进行简单的更换。根据获知实验要求,一部分荧光用来获得光谱信息。单分子的强度波动,荧光衰减特性和光谱数据可以同时获得。光谱随时间的变化以及不同分子的光谱比较都可以通过MicroTime200对光谱仪的结合而成为可能。

Examples示例:
单分子成像
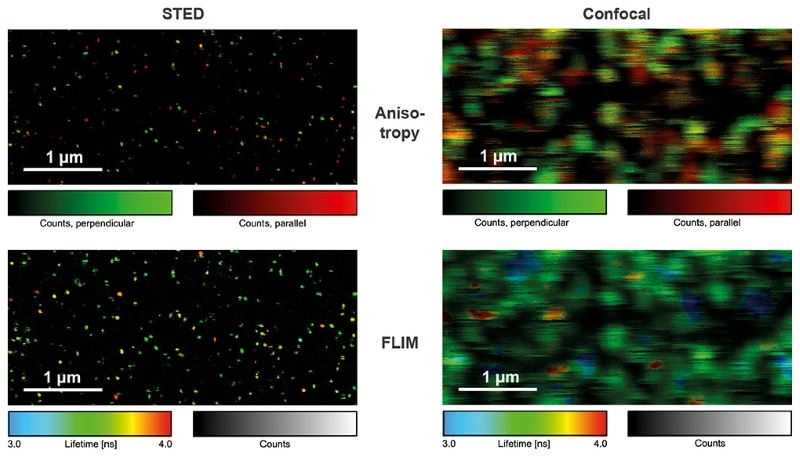
单分子荧光的检测在生物化学、药物开发和基础研究中具有重要意义。单分子灵敏度的系统旨在最小化光学元件的数量以最大化光通量,这就是为什么通常使用压电扫描系统的原因。借助FLIMbee附件,MicroTime200保留了其出色的单分子灵敏度,并且现在有更高的扫描速度。此例中所示图是在盖玻片上的单个ATTO 655分子获得的,在STED和共聚焦的条件下成像,并获得偏振和时间分辨数据。通过使用脉冲交替激发(PIE),可以同时获取STED和共聚焦数据,使单分子闪烁和漂白的分析变得简单明了。
实验配置:
MicroTime
200
振镜:FLIMbee
TCSPC
单元:TimeHarp 260 PICO
激发光:LDH-D-C-640,640 nm
数据分析:SymPhoTime 64
FLIM-STED
超分辨STED 成像现在已经成为分子生物学的一个完善的工具。可以通过多种参数来研究单分子、细胞和组织样品,例如发射光颜色,偏振和荧光寿命。通过MicroTime 200 STED,可以轻松记录超分辨FLIM图像,而FLIMbee的高扫描速度有助于减少STED成像过程中的光毒性和漂白。
这个例子展示了贴壁细胞中微管网络的图像。STED的分辨率更高,可以更细节地研究网络内的相互作用。
实验设置:
MicroTime 200 STED
振镜:FLIMbee
TCSPC单元:TimeHarp 260 PICO
激发波长:640 nm,LDH-D-C-640
STED 激光:765 nm,VisIR-765 STED
数据分析软件:SymPhoTime 64
同时测量拓扑和荧光参数
在本例中,从同一样本区域同时记录染料标记小球的荧光和拓扑信息。上图所示的荧光参数(如发射强度和寿命)是在MicroTime 200 STED上以STED超分辨率(<50 nm)获得的。将JPK
NanoWizard 3原子力显微镜(AFM)连接到耦合后,可以记录同一样品的高度图(如下图所示)。
荧光寿命成像(FLIM)与AFM连用后,为研究例如生物材料中的结构-荧光相互作用提供了更好的途径。
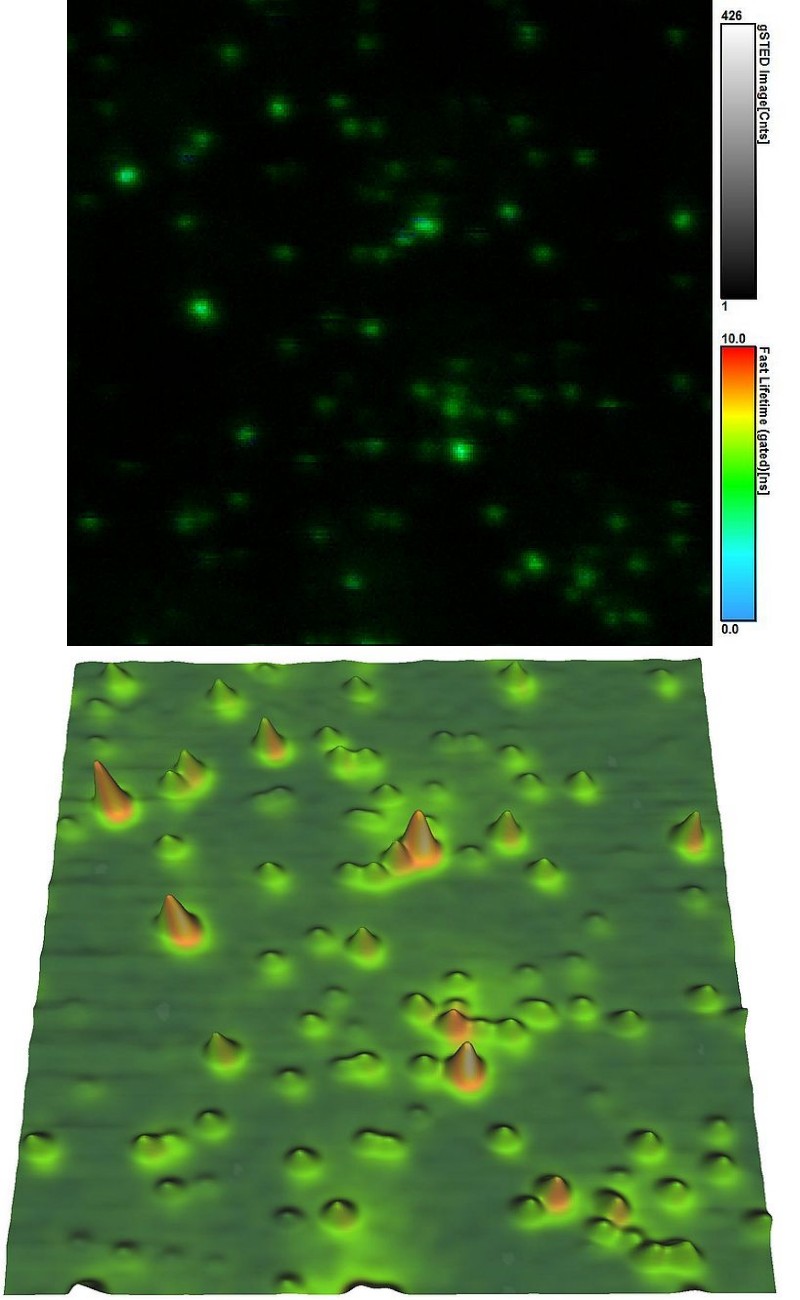
实验设置:
MicroTime
200 STED
振镜扫描头:FLIMbee
TCSPC单元:TimeHarp 260 PICO
激发波长:640 nm,LDH-D-C-640
STED 激光:765 nm ,VisIR-765 STED
数据分析软件:SymPhoTime 64
用染料标记的20 nm小球
激发波长:640 nm
STED 激光:765 nm
PDL 828 “Sepia II”激光控制器,带 SOM 828-D 振荡器模块
JPK NanoWizard 3 AFM
用于超分辨率显微的多色纳米尺
可以使用标记有两种不同染料的纳米尺来评估衍射极限显微镜的分辨率。这个例子显示GATTAquant 的STED 140RYR纳米尺,标有两个红色染料(末端)和一个黄色染料(中部)。红色和黄色标记之间的距离是70nm,而同一纳米尺上的两个红色染料之间的距离是140nm。
实验设置:
激发波长:595 和640 nm
损耗激光:765nm
驱动器:PDL 828“Sepia II”,带SOM 828-D振荡器模块
样品由GATTAquant 公司提供
PIE-STED荧光相关光谱
荧光相关光谱(FCS)是研究分子在溶液或膜中扩散行为的一种既定方法。在共聚焦条件下,FCS观测体积的最小尺寸受衍射极限的限制。然而,这种限制能够通过利用受激发射损耗(STED)来规避,并且可以通过增加STED激光强度逐步缩小观察体积。
在低STED激光功率下,强度的小幅增加会导致横向观察区域直径的迅速缩小。从0到50 mW,根据所使用的荧光团,光斑直径从250nm减小到<100 nm。然而,在高STED功率下,强度增加将导致收缩变慢,直到可以达到小于50 nm的直径。
缩小聚焦体积有助于克服长传输路径中的平均问题,也有助于确定脂质膜中荧光团的阻碍扩散行为类型。此外,对激发光和STED激光使用脉冲交替激发方案,能够在共聚焦和STED条件下近乎同时地收集FCS数据。PIE-STED-FCS可以直接检测STED激光器是否对所研究的扩散动力学有影响。
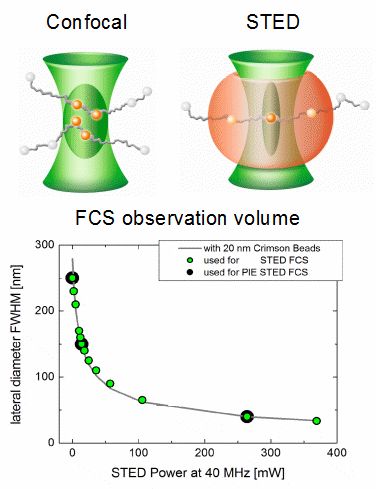
实验设置:
激发光:640 nm
损耗光:765 nm
驱动器:PDL 828“Sepia II”,带SOM 828-D振荡器模块
参考:Koenig, M.等人, Proceedings of SPIE, Vol.9712, 97120T (2016)
细胞骨架–微管
该示例显示了用Abberior STAR635p标记的HeLa细胞中的微管蛋白结构。超分辨率可以更清晰地区分STED图像中的丝状结构。
实验设置:
激发光:640 nm
损耗光:765 nm
FLIM-STED模式匹配功能用于双样本分离
可以通过使用两个不同的640和660 nm皮秒半导体激光器的脉冲交替激发(PIE)来区分两种荧光物质,且荧光通过在两个光谱波段进行检测。荧光模式匹配用于识别每个荧光团的成分。这个例子利用了单个STED损耗光,U2OS细胞的微管蛋白用Abberior
STAR 635p(绿色)标记,巨蛋白用Atto647N(红色)标记。
实验设置:
激发波长:640 ,660 nm
损耗激光:765 nm
驱动器:PDL 828“Sepia II”,带SOM 828-D振荡器模块
样品由德国维尔茨堡大学的Markus Sauer提供
深红荧光小球
该示例显示了深红荧光小球(直径20 nm)的共聚焦和STED图像之间的比较。荧光小球通常用于评估显微镜的分辨率。
共聚焦图像中FWHM为260 nm,而STED图像中的FWHM为38 nm。
分辨率提升显而易见。
实验设置:
激发波长:640 nm
损耗激光:765 nm
用DNA折叠评估分辨率
现在,通常使用经过特殊标记的DNA折叠来评估突破衍射极限显微镜的分辨率。这里使用了具有71nm的距离的两排11个染料分子的折叠。 图像尺寸:4 µm x 4µm
实验设置:
激发波长:640 nm
损耗激光:765 nm
Latest 10 publications referencing MicroTime 200, SymPhoTime
The following list is an extract of 10 recent publications from our bibliography that either bear reference or are releated to this product in some way. Do you miss your publication? If yes, we will be happy to include it in our bibliography. Please send an e-mail to info@picoquant.com containing the appropriate citation. Thank you very much in advance for your kind co-operation.
DDX3X and DDX3Y constitutively form nano-sized RNA-protein clusters that foster enzymatic activity
Yanas A., Shweta H., Owens M.C., Liu K.F., Goldman Y.E.
bioRxiv, preprint (2025)
Reference to: MicroTime 200, Pulsed Diode Lasers (PDL Series, LDH-Series, LDH-FA Series), HydraHarp 400, SPADs
Breaking the low concentration barrier of single-molecule fluorescence quantification to the sub-picomolar range
Veedu M.K., Wenger J.
Optics (2025)
Reference to: Pulsed Diode Lasers (PDL Series, LDH-Series, LDH-FA Series), HydraHarp 400, SymPhoTime
Related to: FCS
Characterization and structural basis for the brightness of mCLIFY: a novel monomeric and circularly permuted bright yellow fluorescent protein
Shweta H., Gupta K., Zhou Y., Cui X., Li S., Lu Z., Goldman Y.E., Dantzig J.A.
Research Square, preprint (2024)
Reference to: MicroTime 200, Pulsed Diode Lasers (PDL Series, LDH-Series, LDH-FA Series), SymPhoTime
Related to: FLIM, FRET
Plasmon mediated single photon emission from a nanocrystal ensemble
Mondal P., Saha S.K., Roy P., Vasudeva N., Anshu A., Rajasekar G.P., Pandey A.
The Journal of Physical Chemistry Letters, Vol.015, p.7556-7565 (2024)
Reference to: MicroTime 200
Functionalization of fibrous substrates with mesoporous silica nanoparticles as a strategy to obtain Photodynamic antibacterial textiles
da Silva A.C.P., Arruda L.M., Moreira I.P., Scacchetti F.A.P., de Oliveira H.P.M., Samulewski R.B., Fangueiro R., Ressaro A.L.
Dyes and Pigments, Vol.230, 112342 (2024)
Reference to: MicroTime 200, FluoTime 300
Single-point substitution F97M leads to in cellulo crystallization of the biphotochromic protein moxSAASoti
Marynich N.K, Boyko K.M, Matyuta I.O, Minyaev M.E, Khadiyatova A.A, Popov V.O, Savitsky A.P.
Biochemical and Biophysical Research Communications, Vol.732, 150419 (2024)
Reference to: MicroTime 200, SymPhoTime
CsPbBr3 perovskite crack platelet nanocrystals and their biexciton generation
Bera S., Tripathi A., Titus T., Sethi N.M., Das R., Afreen, Adarsh K.V., Thomas K.G., Pradhan N.
Journal of the American Chemical Society, Vol.146, p.20300-20311 (2024)
Reference to: MicroTime 200, Pulsed Diode Lasers (PDL Series, LDH-Series, LDH-FA Series)
Quantitative comparison of recombination rates of core/shell quantum dots in colloidal solutions and self-assembled monolayer superlattices
Brinn R.M., Yan C., Abbas A.S., Ondry J., Alivisatos A.P.
The Journal of Physical Chemistry C., Vol.128, p.12131-12140 (2024)
Reference to: MicroTime 200
Conformation of factor Xa in solution revealed by single molecule spectroscopy
Stojanovski B.M., Di Cera E.
Journal of Thrombosis and Haemostasis, Vol.022, p.2767-2772 (2024)
Reference to: MicroTime 200
Rotational and translational diffusion of biomolecules in complex liquids and HeLa cells
Michalski J., Kalwarczyk T., Kwapiszewska K., Enderlein J., Poniewierski A., Karpińska A., Kucharska K., Karpińska R.
Soft Matter, Vol.020, p.5810-5821 (2024)
Reference to: PicoHarp 300, SymPhoTime
Related to: FCS
The following documents are available for download:
- Brochure about the MicroTime 200 STED
- Brochure about the MicroTime 200
- Brochure about the FLIMbee galvo scanner
Related technical and application notes:
- Technical note: Spectrograph Add-on for the MicroTime 200
- Technical note: Combination of MicroTime 200 with Asylum AFM
- Technical note: Combination of MicroTime 200 with Bruker AFM
- Technical note: Combination of MicroTime 200 with JPK AFM
- Technical note: Sample temperature controller for the MicroTime 200
- Technical note: Time-Correlated Single Photon Counting (TCSPC)
- Technical note: FLIM. Scanning Speed vs. Excitation Rate
- Technical note: Phosphorescence Lifetime Imaging Microscopy (PLIM) Measurements. Practical Aspects
- Application note: Quantitative Fluorescence Correlation Spectroscopy
- Application note: Time-gated Fluorescence Correlation Spectoscopy
- Application note: Absolute diffusion coefficients
- Application note: Two-Focus Fluorescence Correlation Spectroscopy (2fFCS)
- Application note: Fluorescence Lifetime Correlation Spectroscopy (FLCS)
- Application note: Fluorescence Lifetime Imaging (FLIM) in Confocal Microscopy
- Application note: Imaging of molecular distances using FLIM-FRET
- Application note: FRET analysis with Pulsed-Interleaved Excitation (PIE)
- Application note: Two-photon excitation using the MicroTime 200