荧光显微镜
LSM Upgrade Kit
共聚焦显微镜FLIM/FCS升级套件
- FLIM, FRET, FCS的交钥匙系统
- 紧凑、易用、免维护的组件,所有的升级系统各个配置都高度模块化,具有无限的灵活性
- 最大4通道独立探测模块的高灵敏系统
- 荧光寿命探测范围从<100ps到微秒级别
- 高端易用、匹配多种分析方式的数据收集和分析软件
- 可用于各向异性和厚组织FLIM
-
新功能:rapidFLIMHiRes——利用超快FLIM成像和出色的5 ps时间分辨率实现动态过程可视化
激光扫描共聚焦显微镜(LSM)是生物化学,细胞生物学和其他相关生命科学领域中广泛使用的工具。 通过使用时间分辨技术,可以进一步增强这些显微镜的功能,并具有以下优点:
- 基于荧光寿命的荧光共振能量转移(FRET)效率量化测量
- 利用时间分辨成像测量环境参数(pH,离子浓度)
- 寿命测量与荧光团浓度无关
- 利用荧光寿命拆分发射光谱重叠的荧光分子
- 减少所需检测器的数量——一个检测器足以根据不同荧光团的特定寿命通过模式匹配同时检测不同荧光团
- 用荧光寿命区分荧光对弹性和拉曼散射及其他背景噪声造成的影响
- 荧光寿命作为一个进一步的参数提高了分析测量的准确性
该升级套件作为激光扫描显微镜升级部件,在增强了功能性的基础上,更使整个系统简单易用。作为交钥匙系统,它主要包含三个单元:皮秒脉冲激发源,单分子灵敏度检测器,以及时间相关单光子计数(TCSPC)模块
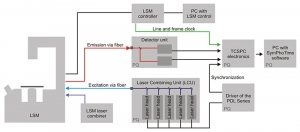
灵活的激发系统
所有含有常用荧光团的样品均可使用LSM升级套件进行检测。激发子系统由PDL系列的脉冲二极管激光器驱动器和具有皮秒脉冲的不同激光头组成(附加的CW模式可供选择)。

可用波长范围为375至900 nm。所有的激光头都集成在一个激光耦合单元(LCU)中,最后统一耦合进入光纤,大大提高了激光器操作的灵活性、激光衰减调节和耦合的便利性。由于激光的单色性,可使得样品背景明显降低。
重复频率和激光功率可以通过激光驱动器调整,以适应不同荧光寿命,从而最大程度地减少样品的漂白。作为皮秒脉冲半导体激光器的替代方案,特别是对于多光子激发方案,还可以集成第三方飞秒激光器,例如钛:蓝宝石激光器。

皮秒分辨率的计数单元
LSM升级套件可轻松测量从皮秒至数毫秒的荧光和磷光寿命。广泛的测量范围涵盖了生命以及材料科学领域中几乎所有能被分析的样品。时间分辨显微不仅需要对光子本身进行记录,还需要对它们在时间上以及在空间成像中的位置进行记录。对此的理想技术是PicoQuant开发的时间标记的时间分辨(TTTR)数据采集,它是时间相关的单光子计数(TCSPC)的经典方法的另一种形式。使用TTTR数据采集,仅仅基于一种数据格式,只是通过执行各种不同的测量程序,就可以实现譬如FLIM,FLIM-FRET,FCS甚至一致性相关(“反聚束”)等测量。 PicoQuant的所有可用TCSPC设备均支持TTTR格式,可提供具有最多8个独立的通道,可用于快速和并行检测,这些模块提供最高的数据通量,Multi-stop功能和超低死时间,以实现较短的采集时间。

最高灵敏度的单光子敏感探测
为了确保最佳的实验条件,LSM升级套件提供了四种不同的探测器类型:
- Hybrid PMT,是FLIM,FCS和NDD厚组织成像的最佳选择
- PDM SPAD, 用于FLIM和FCS的高时间分辨的探测器
- SPCM-AQRH SPAD,最适合FCS的高灵敏度探测器
- PMA系列的光电倍增管(PMT),FLIM的经济型选择
Hybrid PMT和SPAD可提供单分子实验所需的最高灵敏度,适用于例如低荧光强度细胞的FLIM/FCS研究。探测器的效率、时间分辨率、光谱范围和或有效感光区域各有不同。因此,检测器的选型取决于多个因素,例如显微镜的共聚焦接口或NDD检测接口。

共聚焦和NDD探测
探测器可以用针孔以共聚焦模式连接,适用于所有类型的探测器,也可以使用NDD方式进行多光子激发。
在标准共聚焦模式下,探测器通过光纤连接到显微镜的光纤出口。在这种共聚焦配置中,最多可使用4个探测器。集成的滤光片支架可快速更换发射滤光片,以适应不同的实验条件和荧光团。
NDD用于具有多光子激光器的系统,也可用于厚组织FLIM。在这种情况下,一个或两个检测器(PMT或Hybrid PMT)通过一个大芯径液体光导管连接到LSM。可以将光导管安装在显微镜的合适NDD端口上,或者使用专门开发的燕尾适配器将荧光在物镜上方直接收集。后一种方法的特点是具有非常高的收集效率,这是由于非常接近物镜进行光收集以及通过液体光导的高传输率。如果使用Olympus FluoView FV1000 / 1200 MPE系统,则还可以使用多达四个LSM的内部NDD标准PMT检测器进行FLIM测量。
多通道探测单元
为了满足更多应用需求,多通道探测单元允许并行共聚焦、偏振和NDD测量,并具有多达四个探测通道,用于多色FLIM、FRET、深层组织FLIM成像、自相关和互相关(FCS, FLCS,FCCS,FLCCS)以及各向异性研究。有如下几种检测配置:
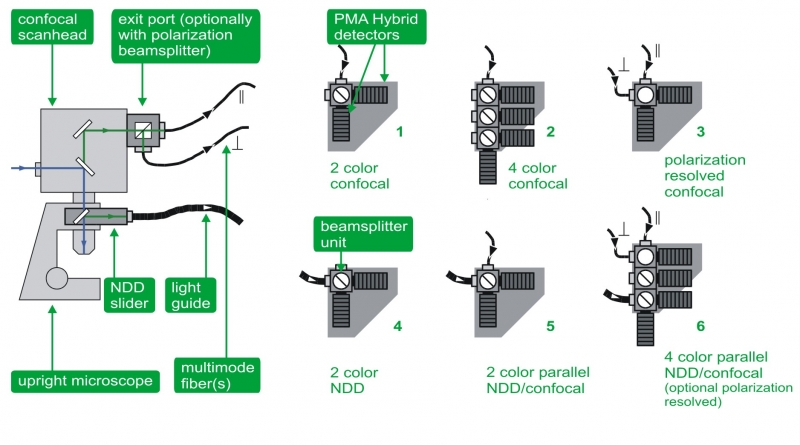
1、用于FLIM、FRET、自相关和互相关的双通道共聚焦探测(FCS、FLCS、FCCS、FLCCS)
2、用于FLIM、FRET、自相关和互相关的标准四通道共聚焦探测(FCS、FLCS、FCCS、FLCCS)
3、各向异性成像的双通道偏振共聚焦探测
4、用于厚组织FLIM和FRET的双通道NDD探测
5、并行双通道设置可实现共聚焦和NDD探测,以进行双色FLIM、FRET、厚组织FLIM成像、自相关和互相关(FCS、FLCS、FCCS、FLCCS)
6、并行四通道设计可实现共聚焦和 NDD探测,并可选偏振测量,以进行多色FLIM、FRET、厚组织FLIM成像、自相关和互相关(FCS、FLCS、FCCS、FLCCS)以及各向异性。
直观的软件
系统软件SymPhoTime 64为各种样品提供了多种易于使用的采集和分析功能。
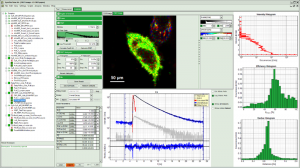
基于尖端的数据采集和处理方式,系统软件SymPhoTime 64支持多种分析方法,譬如强度随时间轨迹分析、突发分析、寿命柱状图、荧光相关光谱(FCS)、荧光寿命相关光谱(FLCS)、荧光寿命成像(FLIM)、荧光共振能量转移(FRET)和各向异性等。SymPhoTime 64采用一个透明的数据结构,所有数据都存放在一个工作区中,包括来跟踪所有测量的一个日志文件和分析步骤。图像数据可以进一步处理或导出为标准格式。大量的分析方法都已经集成在软件中,为准备发表的数据提供一个分析平台。与此同时,SymPhoTime64提供了强大的灵活性、新颖的整合能力、以及尖端的算法。专用脚本语言接口允许用户修改和增强分析程序。
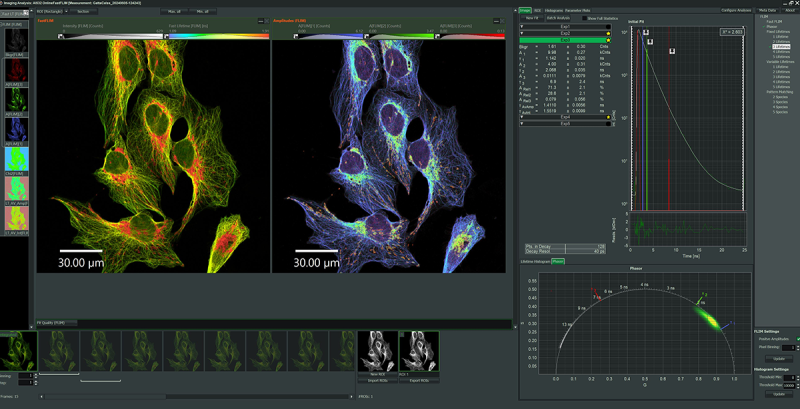
利用 NovaFLIM 软件包可以进行高级离线图像分析。NovaFLIM 具有极快的 GPU 加速 FLIM、FLIM-FRET 和各向异性数据分析功能。对 Z 叠片、延时序列和拼接图像进行高效的批量分析,以及先进、灵活和可重现的 ROI 处理,可实现高质量的图像分析。
SymPhoTime 64和LSM软件(Nikon和ZEISS)之间专门开发的接口,极大地方便了数据采集,并可以直接记录例如高达4096×4096像素的FLIM图像、时间序列FLIM、z-stacks以及FCS的单点和多点测量。主要参数(快速FLIM,FCS,时间轨迹或TCSPC直方图)的在线预览可以快速优化数据采集过程。
相关视频
|
激发系统 |
激光耦合台,基于皮秒脉冲半导体激光器(功率/重复频率可调, 最大80MHz) 375-900nm波长范围 支持单通道或者多通道驱动 可选:支持外接第三方激光器 (如钛蓝宝石飞秒激光器和超连续谱激光器) 新品:采用LDH-D-TA-560的560 nm皮秒脉冲激发 |
|
支持显微镜的厂家型号 |
Nikon:AX,A1, C2+, C2, C1si Olympus: FluoView FV3000, FVMPE-RS, FluoView FV1200 (MPE), FluoView FV1000 (MPE) Scientifica:VivoScope, HyperScope Zeiss:LSM 980, LSM 880, LSM 780, LSM 710 |
|
探测方式 |
最多可支持4通道相互独立的探测模块 共聚焦和NDD配置 通过光纤与显微镜连接 |
|
探测器 |
单光子雪崩二极管(SPAD) · 混合型光电倍增管(Hybrid-PMT) · 光电倍增管(PMT) |
|
数据采集方式 |
基于时间相关单光子计数(TCSPC)的TTTR测量模式 · 多达四个通道的同时数据采集 |
|
采集和软件 |
SymPhoTime 64 NovaFLIM(新增软件) |
- 时间分辨荧光
- rapidFLIM - 重新定义动态FLIM成像标准
- 荧光寿命成像(FLIM)
- 磷光寿命成像(PLIM)
- 荧光相关光谱(FCS)
- 荧光寿命相关光谱(FLCS)
- 荧光互相关光谱(FCCS)
- 荧光共振能量转移(FRET)
- 脉冲交替激发(PIE)
- 激光切割/烧蚀
- 模式匹配分析
- 时间分辨光致发光(TRPL)
- TRPL 成像
- 反聚束效应
- 各向异性
机械刺激时的细胞内 Ca2+ 信号传递
装有 Oregon-Green-Bapta-1 的 HEK 细胞受到机械刺激后产生的细胞内 Ca2+ 信号。在这段视频中,对上面两个细胞进行了机械刺激前、刺激过程中和刺激后的成像。机械刺激导致细胞吸收钙离子。Ca2+ 浓度的增加导致 OGB-1 AM 的荧光寿命发生变化,顶部两个细胞在短时间内亮起绿光。rapidFLIMHiRes 方法能够以每秒 5 帧 FLIM 的速度对 128 x 128 像素的样品区域进行成像,从而能够在短时间内定量观察细胞中钙离子浓度的上升。
样品详情:
- 人工脑脊液中装载了Oregon-Green-Bapta-1 (OGB-1 AM)的人类胚胎肾(HEK)细胞
实验配置:
- 128 x 128 像素,3.81 µs像素驻留时间
- 每秒 5 帧
样本和数据由 Rose 教授(德国杜塞尔多夫海因里希-海涅大学神经生物学研究所)提供
用rapidFLIMHiRes 监测膜张力的变化

这段视频展示了用荧光探针 Fliper-TR®(荧光脂质张量报告)对细胞膜进行染色的 MDCK 细胞。该探针嵌入密闭环境后,荧光寿命会发生显著变化。如果施加横向压力,Fliper-TR® 会发生平面化,从而导致荧光寿命的改变,这就可以对活细胞和人工膜中的脂质成分和膜张力进行成像。在等渗条件下,Fliper-TR® 的荧光寿命约为 5.1 ns。诱导高渗休克后,膜张力迅速降低,荧光寿命缩短。使用 rapidFLIMHiRes 方法进行成像的速度非常快,因此可以实时记录荧光寿命的变化以及膜张力的变化。
样品详情:
- 用 Fliper-TR® 染色的麦丁-达比犬肾(MDCK)细胞膜
实验配置:
- 激发:485 nm
- 图像大小: 512 x 256 像素
- 每秒 1.0 帧
参考文献 Colom, A., Derivery, E., Soleimanpour, S. et al. A fluorescent membrane tension probe. Nature Chem 10, 1118-1125 (2018). https://doi.org/10.1038/s41557-018-0127-3
rapidFLIM - 重新定义动态FLIM成像标准
利用rapidFLIM荧光寿命成像技术,可以有效地对样品的多种动态过程进行荧光寿命成像。该技术支持下的FLIM采集过程非常迅捷,可达到每秒几帧的速度,适用于记录样品的动态过程(例如蛋白质相互作用,化学反应和离子流动),以及针对流动性高的样品的进行成像(流动性高的细胞器或颗粒,细胞的迁移等),同时还可以用于研究荧光共振能量转移的动态特性。最高每秒可获取10帧以上,具体取决于样本的亮度和图像大小。
单层囊泡具有从巨型(GUVs)到大型(LUVs)甚至到小型(SUVs)等多种尺寸。囊泡膜的柔性结构允许引入特殊标记的脂质,从而使得它们非常适合在生物物理研究中作为研究对象。因此,这种囊泡成为了研究例如模结构域的形成或脂质组织的强大模型。
到目前为止,传统获取FLIM图像都需要花费几分钟的时间,并且由于GUV的高移动性,很难对它们进行精确成像。应用rapidFLIM方法可显著减少采集时间,每秒可记录数帧。因此,即使是高度移动的GUV,也可以精确跟踪。在该示例中,将两个荧光团标记的脂质(C6-NBD-PC和N-Rhd-DOPE)掺入GUV中。在无相分离的GUV中,由于受体罗丹明的FRET过程,NBD(7-nitrobenz-2-oxa-1,3-diazol-4-yl)的寿命被强烈淬灭(低至约2 ns)。此处显示的视频包含300帧,以5.6 fps的帧率记录。
样品详细:
具有NBD和罗丹明标记的脂质的GUVs(无相分离):DOPC + 0.5 mol % Palmitoyl-C6-NBD-PC + 0.5 mol % N-Rhd-DOPE
NBD标记的Palmitoyl-C6-NBD-PC(磷脂酰胆碱)
罗丹明标记的N-Rhd-DOPE(二油基磷脂酰乙醇胺)
实验配置:
- 激发光: 485 nm、40 MHz
- 长通滤光片: 488 nm
- 75 x 75 µm,300 x 300像素, 1 µs/像素
- 300帧,每秒5.6帧
GUV由柏林洪堡大学分子生物物理实验室的Ivan Haralampiev制备
使用荧光寿命确定脂质顺序
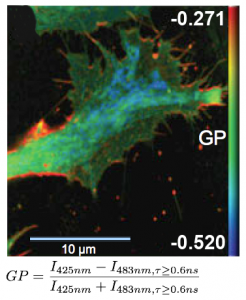
FLIM测量有助于区分有序和无序的膜相。在液相有序和无序之间变化时,膜染料Laurdan和di-4-ANEPPDHQ会发生荧光发射光谱蓝移以及的寿命偏移,因此它们可以用来做膜序的成像。这些图像通常采用归一化强度比图像的形式,通常称之为广义极化(GP)图。在这里,通过时间相关单光子计数(TCSPC),利用已知的激发态光物理,可以来证明这两个荧光探针的GP对比度的增强。该图显示了结合了寿命和光谱变化的Laurdan染色的固定BAEC细胞的GP图。与内部细胞室(蓝色)相比,细胞表面的质膜显示出更高的阶数(红色)。
实验配置:
结合了MicroTime 200和LSM升级套件(Leica TCS SP5)
激发光:800 nm的双光子激发,SpectraPhysics MaiTai
分析软件:SymPhoTime
澳大利亚新南威尔士大学血管研究中心Katharina Gaus提供
参考文献:Owen et al., Microsc. Res. Tech. 73(6), (2010)配置
Nikon:
- 激发波长:375 nm-900 nm
- 并行连接PicoQuant的脉冲激光器和MPE激光器(Nikon A1 MP)
- 同时使用PicoQuant的脉冲激光和Nikon A1的CW激光
- 同时使用PicoQuant的脉冲激光和Nikon A1的CW激光
- 将PicoQuant探测器连接到LSM(Nikon A1)的特殊出口
- PicoQuant探测器和Nikon光谱探测单元(Nikon C1si,C2)或Nikon PMT探测单元(Nikon C1,C2)的切换式耦合
- 用于共聚焦和NDD成像以及偏振测量的并行设置(Nikon A1)
- 将SymPhoTime 64集成到LSM NIS软件中,以方便FLIM和FCS数据获取
- 使用功能强大的SymPhoTime 64软件进行数据分析
- 在NIS元件中完全控制PicoQuant脉冲激光,以实现用JOBS进行高通量FLIM筛选
有关详细信息,请查看NikonA1、C1si和C2+、C1和C2的选择表。
Olympus
- 激发波长:405-900nm(FV3000)和375-900nm(FV1200/FV1000)
- 同时使用来自PicoQuant的脉冲激光器和来自Olympus的CW激光器,与激发波长无关
- 在普通或SIM振镜上使用脉冲激光
- 将PicoQuant探测器连接到LSM的特殊出口
- 用于共聚焦和NDD成像(FV1000MPE,FV1200MPE)以及偏振测量的并行设置
- 使用功能强大的SymPhoTime 64软件进行数据分析
- 厚组织FLIM可最多使用四个内部NDD PMT(FV1000MPE,FV1200MPE)
有关详细信息,请检查FluoView FV3000,FluoView FV1000(MPE)/ FV1200(MPE)和FVMPE-RS的选择表。
Scientifica
- 使用MPE激光
- 多达四个内部NDD检测器用于厚组织FLIM
- 将PicoQuant单光子探测器用于标准NDD成像
- FLIM和NDD强度成像的并行设置
- 使用功能强大的SymPhoTime 64软件进行数据分析
Zeiss
- 激发波长:405 nm-640 nm
- 并行安装PicoQuant和Zeiss的脉冲激光
- 并行安装PicoQuant可见光脉冲激光器和MPE激光器
- 将PicoQuant探测器连接到LSM的特殊出口
- PicoQuant探测器与ConfoCor单元(LSM 710)的同时耦合
- NDD与NLO联用,应用于正置和倒置显微镜
- 单通道和双通道NDD(LSM 710 NLO / LSM 780 NLO)
- 用于共聚焦和NDD成像以及偏振测量的并行设置
- 使用功能强大的SymPhoTime 64软件进行数据采集和分析
- 将SymPhoTime 64集成到ZEISS的 ZEN软件中,更加方便FLIM和FCS数据采集
有关详细信息,请查看Zeiss LSM 710/780/880/980的选择表。
Leica
- 激发波长:405 nm、440 nm、470 nm和640 nm (TCS SP5 / SP8)
- 同时使用PicoQuant的脉冲激光器和Leica的CW激光器
- 并行配置PicoQuant的405 nm脉冲激光器和MPE激光器
Latest 10 publications referencing LSM Upgrade Kit, SymPhoTime
The following list is an extract of 10 recent publications from our bibliography that either bear reference or are releated to this product in some way. Do you miss your publication? If yes, we will be happy to include it in our bibliography. Please send an e-mail to info@picoquant.com containing the appropriate citation. Thank you very much in advance for your kind co-operation.
Breaking the low concentration barrier of single-molecule fluorescence quantification to the sub-picomolar range
Veedu M.K., Wenger J.
Optics (2025)
Reference to: Pulsed Diode Lasers (PDL Series, LDH-Series, LDH-FA Series), HydraHarp 400, SymPhoTime
Related to: FCS
Characterization and structural basis for the brightness of mCLIFY: a novel monomeric and circularly permuted bright yellow fluorescent protein
Shweta H., Gupta K., Zhou Y., Cui X., Li S., Lu Z., Goldman Y.E., Dantzig J.A.
Research Square, preprint (2024)
Reference to: MicroTime 200, Pulsed Diode Lasers (PDL Series, LDH-Series, LDH-FA Series), SymPhoTime
Related to: FLIM, FRET
Single-point substitution F97M leads to in cellulo crystallization of the biphotochromic protein moxSAASoti
Marynich N.K, Boyko K.M, Matyuta I.O, Minyaev M.E, Khadiyatova A.A, Popov V.O, Savitsky A.P.
Biochemical and Biophysical Research Communications, Vol.732, 150419 (2024)
Reference to: MicroTime 200, SymPhoTime
Rotational and translational diffusion of biomolecules in complex liquids and HeLa cells
Michalski J., Kalwarczyk T., Kwapiszewska K., Enderlein J., Poniewierski A., Karpińska A., Kucharska K., Karpińska R.
Soft Matter, Vol.020, p.5810-5821 (2024)
Reference to: PicoHarp 300, SymPhoTime
Related to: FCS
Deep learning reduces data requirements and allows real-time measurements in imaging FCS
Tang W.H., Sim S.R., Aik D.Y.K., Nelanuthala A.V.S., Athilingam T., Röllin A., Wohland T.
Biophysical Journal, Vol.123, p.655-666 (2024)
Reference to: MicroTime 200, Pulsed Diode Lasers (PDL Series, LDH-Series, LDH-FA Series), LSM Upgrade Kit, SymPhoTime
Related to: FCS
Protein aggregation monitoring in cells under oxidative stress: a novel fluorescent probe based on a 7-azaindole-BODIPY derivative
Herrera Ochoa D., Llano I., Ripoll Lorente M.C., Cybulski P., Kreuzer M., Rocha S., García Frutos E.M., Bravo Pérez I., Garzón Ruiz A.
Journal of Materials Chemistry B, Vol.012, p.7577-7590 (2024)
Reference to: MicroTime 200, SymPhoTime
Control of hybrid exciton lifetime in MoSe2/WS2 moiré heterostructures
Xu H., Wang J., Liu H., Chen S., Sun Z., Wang C., Han R., Wang Y., Wang Yu., Wang Z., Huang S., Ma L., Liu D.
Advanced Science, Vol.011, 2403127 (2024)
Reference to: MultiHarp 150, SymPhoTime
Interplay between a heptamethine cyanine de sensitizer (IR806) and lanthanide upconversion nanoparticles
Liu H., Kulkarni A., Kostiv U., Sandberg E., Lakshmanan A., Sotiriou G.A., Widengren J.
Advanced Optical Materials, Vol.012, 2400987 (2024)
Reference to: HydraHarp 400, SymPhoTime
Transfer of hexagonal boron nitride quantum emitters onto arbitrary substrates with zero thermal budget
O`Hara D.J., Chuang H.-J., McCreary K.M., Noyan M.A., Lee S.-J., Cobas E.D., Jonker B.T.
APL Materials, Vol.012, 071104 (2024)
Reference to: MicroTime 200, SymPhoTime
smICA: an open source repository for mapping the concentration of fluorescenctly labeled molecules in living cells on the basis of confocal imaging combined with time-correlated single-photon counting
Kalwarczyk T., Bubak G., Michalski J., Kwapiszewska K., Pilz M., Mamot A., Jemielity J., Hołyst R.
Quantitative Methods (2024)
Reference to: Pulsed Diode Lasers (PDL Series, LDH-Series, LDH-FA Series), PicoHarp 300, LSM Upgrade Kit
Related to: FCS
The following documents are available for download:
- Brochure LSM Upgrade Kit
- Selection chart for Nikon A1
- Selection chart for Nikon C1
- Selection chart for Nikon C1si and C2 with Lu4 Laser Combiner
- Selection chart for Nikon C2+ with LUN Laser Combiner
- Selection chart for Olympus FV1000 and FV1200
- Selection chart for Olympus FV3000
- Selection chart for Olympus FVMPE-RS
- Selection chart for Zeiss LSM 710/780/880/980
- NIS-Elements PicoQuant FLIM & FCS Software Control Plug-in
- Poster: Quick Reference for confocal time-resolved microscopy (FLIM, FRET, FCS)
- Practical Manual for Fluorescence Microscopy Techniques
Presentations (as PDF files)
Related technical and application notes:
- Application note: rapidFLIM - an Innovative Method for Ultrafast FLIM
- Technical note: Upgrading Laser Scanning Microscopes with FLIM & FCS
- Technical note: Combination of pulsed and cw lasers on a Olympus LSM
- Technical note: FLIM NDD Upgrade Kit for the Olympus FluoView FV1000MPE
- Technical note: Polarization Extension Unit for LSM Upgrade Kits
- Technical note: ROI scanning using pulsed lasers on a Olympus FluoView
- Technical note: Time-Correlated Single Photon Counting (TCSPC)
- Application note: Fluorescence Lifetime Imaging (FLIM) in Confocal Microscopy
- Application note: Imaging of molecular distances using FLIM-FRET
- Application note: FRET analysis with Pulsed-Interleaved Excitation (PIE)
- Application note: Time-gated Fluorescence Correlation Spectoscopy
- Application note: Fluorescence Lifetime Correlation Spectroscopy (FLCS)
- Technical Note: Phosphorescence Lifetime Imaging Microscopy (PLIM) Measurements - Practical Aspects